- প্রথম অধ্যায় (রসায়নের ধারণা) – রসায়নের ক্রমবিকাশ
- প্রথম অধ্যায় (রসায়নের ধারণা) – রসায়ন পাঠের গুরুত্ব
- প্রথম অধ্যায় (রসায়নের ধারণা) – রসায়নের পরিসর
- প্রথম অধ্যায় (রসায়নের ধারণা) – বিজ্ঞানের অন্যান্য শাখার সাথে সম্পর্ক
- প্রথম অধ্যায় (রসায়নের ধারণা) – রসায়নে গবেষণা প্রক্রিয়া
- প্রথম অধ্যায় (রসায়নের ধারণা) –পরীক্ষাগার ও রাসায়নিক দ্রব্য ব্যবহারে সতর্কতা
- দ্বিতীয় অধ্যায় (পদার্থের অবস্থা) – কণার গতিতত্ত্ব ও পদার্থের ভৌত অবস্থা
- নবম অধ্যায় (এসিড-ক্ষারক সমতা) – এসিড, ক্ষারক ও ক্ষারের ধারণা
- নবম অধ্যায় (এসিড-ক্ষারক সমতা) – জলীয় দ্রবণে এসিড ও ক্ষারের আচরণ
- নবম অধ্যায় (এসিড-ক্ষারক সমতা) – প্রশমন বিক্রিয়া ও লবণ
- নবম অধ্যায় (এসিড-ক্ষারক সমতা) – লঘু এসিডের শনাক্তকারী ধর্মসমূহ ও পরীক্ষামূলক প্রমাণ
এসিড ও ক্ষারের গুরুত্বপূর্ণ কিছু ধর্ম আছে। যেমন এসিড জলীয় দ্রবণে হাইড্রোজেন আয়ন দান করে এবং ক্ষার হাইড্রোক্সাইড আয়ন দান করে। এই সক্ষমতার কারণে এসিড বা ক্ষার রাসায়নিকভাবে সক্রিয় হয়, অর্থাৎ সহজে বিক্রিয়া করে। ফলশ্রুতিতে বিভিন্ন কিছুর সংস্পর্শে আসলে এসিড বা ক্ষার সেগুলোর ক্ষয়সাধন করতে পারে।
তবে এসিড ও ক্ষার যখন বিক্রিয়া করে, তখন তারা লবণ ও পানি উৎপন্ন করে। এই লবণ অম্লত্ব (এসিডিটি) বা ক্ষারত্ব কোন ধর্মই প্রদর্শন করে না। অর্থাৎ রাসায়নিকভাবে নিরপেক্ষ প্রকৃতির হয়। এসিড বা ক্ষারের মত খুব সহজে বিক্রিয়ায় অংশ নেয় না। অবশ্য লবণ পুরোপুরি নিরপেক্ষ হবে কিনা এখানে শর্ত আছে, সে আলোচনা পরে আসছে।
উদাহরণস্বরূপ, কস্টিক সোডা বা সোডিয়াম হাইড্রোক্সাইড (NaOH) ক্ষার ও হাইড্রোক্লোরিক এসিড (HCl) বিক্রিয়া করে সোডিয়াম ক্লোরাইড (NaCl) লবণ ও পানি উৎপন্ন করে। অসাবধানতাবশত NaOH বা HCl উভয়টির সংস্পর্শ যেখানে বড় ধরণের বিপজ্জনক হতে পারে, সেখানে সোডিয়াম ক্লোরাইড হলো খাবার লবণ আর পানি তো পানি-ই।
NaOH(aq) + HCl(aq) → NaCl(aq) + H₂O(l)
এখানে aq দিয়ে aqueous বা জলীয় দ্রবণ বোঝানো হচ্ছে।
প্রশমন বিক্রিয়া
এসিড ও ক্ষারক বিক্রিয়া করে লবণ ও পানি উৎপন্ন করার বিক্রিয়াকে প্রশমন বিক্রিয়া বলে। সকল প্রকার ক্ষারক প্রশমন বিক্রিয়ায় অংশ নেয়।
ওপরের উদাহরণ যদি দেখি, প্রশমন বিক্রিয়ার ক্ষেত্রে জলীয় দ্রবণে NaOH ক্ষার বিয়োজিত হয়ে Na⁺ ও OH⁻ উৎপাদন করে এবং HCl বিয়োজিত হয়ে H⁺ ও Cl⁻ উৎপন্ন করে। এরপর ক্ষারের Na⁺ ও এসিডের Cl⁻ মিলে NaCl এবং এসিডে H⁺ ও ক্ষারের OH⁻ মিলে H₂O তৈরি করে। জলীয় দ্রবণে NaCl আয়নিত অবস্থাতে থাকে, পানি বাষ্পীভূত করে কঠিন NaCl পাওয়া যায়। এভাবে এক মোল NaOH ও এক মোল HCl পরস্পরকে সম্পূর্ণরূপে প্রশমিত করে এক মোল NaCl ও এক মোল H₂O তৈরি করে।
অন্যদিকে আমরা যদি সালফিউরিক এসিড (H₂SO₄) এর সাথে NaOH এর বিক্রিয়া দেখি,
2NaOH(aq) + H₂SO₄(aq) → Na₂SO₄(aq) + 2H₂O(l)
এক্ষেত্রে বিক্রিয়া সমতা করার পর দেখা যাচ্ছে এক মোল H₂SO₄ কে প্রশমিত করতে দুই মোল NaOH প্রয়োজন হয়। (যেহেতু এক মোল H₂SO₄ বিয়োজিত হয়ে দুই মোল H⁺ আয়ন তৈরি করে)
এখন কেন বিক্রিয়ার পর আয়নগুলোর বিন্যাস পরিবর্তন হচ্ছে? সাধারণভাবে বলছি, আমরা সবসময়ই দেখবো রাসায়নিক দ্রব্যগুলোর একটা স্থিতিশীল অবস্থা অর্জনের প্রবণতা থাকে। গঠনগত কারণে কিছু যৌগ অন্য যৌগের থেকে বেশি স্থিতিশীল হয়। এরকম এসিড ও ক্ষার থেকে লবণ ও পানি বেশি স্থিতিশীল যৌগ। একারণে এসিড ও ক্ষার সক্রিয় বা সহজে বিক্রিয়া করতে চাইলেও লবণ ও পানি কম সক্রিয়তা দেখায়।
উদাহরণ
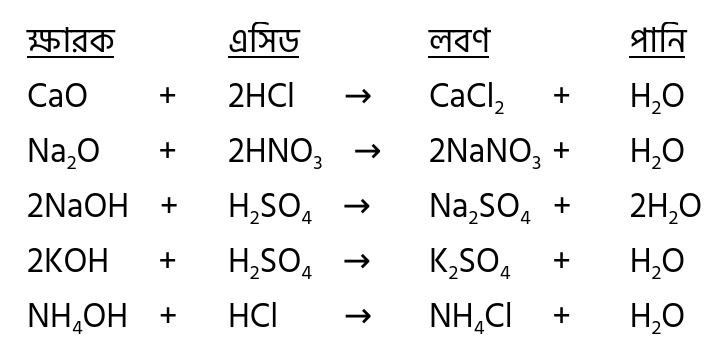
লবণ
লবণ হলো এসিড ও ক্ষারের প্রশমন বিক্রিয়ায় উৎপন্ন নিরপেক্ষ বা প্রশম যৌগ। অবশ্য লবণ তখনই সম্পূর্ণরূপে নিরপেক্ষ হবে যখন প্রশমন বিক্রিয়ায় তীব্র এসিড ও তীব্র ক্ষার অংশ নিবে। যদি শক্তিশালী এসিডের সাথে দুর্বল ক্ষারের প্রশমন বিক্রিয়া হয়, তখন উৎপন্ন লবণের জলীয় দ্রবণ অম্লীয় বা এসিডিক প্রকৃতির হবে। অন্যদিকে দুর্বল এসিডের সাথে শক্তিশালী ক্ষারের প্রশমন বিক্রিয়া হলে লবণের জলীয় দ্রবণ ক্ষারীয় প্রকৃতির হবে। দুর্বল এসিড, দুর্বল ক্ষারের ক্ষেত্রে কোনটা তুলনামূলক শক্তিশালী তার ওপর ভিত্তি করে লবণ সামান্য অম্লীয় বা সামান্য ক্ষারীয় হবে।
লবণের ধনাত্মক আয়ন বা ক্যাটায়ন ক্ষার থেকে আসে। তাই একে ক্ষারীয় মূলক (basic radical) বলে। ঋনাত্মক আয়ন বা অ্যানায়ন আসে এসিড থেকে। তাই একে অম্লীয় মূলক (acidic radical) বলে। অম্লীয় মূলকের ভিত্তিতে বিভিন্ন ধাতুর ক্লোরাইড, সালফেট, নাইট্রেট, ফসফেট, কার্বনেট, বাইকার্বনেট, অ্যাসিটেট প্রভৃতি লবণ পাওয়া যায়।
নিরপেক্ষ লবণ: Na⁺, K⁺, Ca2+ ক্ষারীয় মূলকগুলো শক্তিশালী ক্ষার থেকে আসে। অন্যদিকে Cl⁻, SO₄²⁻, NO₃⁻ প্রভৃতি অম্লীয় মূলকগুলো শক্তিশালী এসিড থেকে আসে। তাই এদের সমন্বয়ে তৈরি লবণগুলো নিরপেক্ষ হবে। যেমন- NaCl, Na₂SO₄, K₂SO₄, KNO₃, CaCl₂, Ca(NO₃)₂ প্রভৃতি।
অম্লীয় প্রকৃতির লবণ: Al3+, Fe2+ (ফেরাস আয়ন), Fe3+ (ফেরিক আয়ন), Zn2+, NH4+ প্রভৃতি দুর্বল ক্ষার থেকে আসে। কাজেই Cl⁻, SO₄²⁻, NO₃⁻ প্রভৃতির সাথে লবণ তৈরি করলে তা অম্লীয় প্রকৃতির হবে। যেমন- AlCl₃, Al₂(SO₄)₃, FeCl₂ (ফেরাস ক্লোরাইড), FeSO₄, Fe(NO₃)₃, FeCl₃ (ফেরিক ক্লোরাইড), Fe₂(SO₄)₃, Fe(NO₃)₃, Zn(NO₃)₂, NH₄Cl প্রভৃতি।
ক্ষারীয় প্রকৃতির লবণ: CO₃2-, PO₄³⁻, HCO₃–, CH₃COO– প্রভৃতি দুর্বল এসিড থেকে আসে। তাই Na⁺, K⁺, Ca2+ এদের সাথে লবণ তৈরি করলে তা ক্ষারীয় প্রকৃতির হয়। যেমন- Na₂CO₃, Na₃PO₄, KHCO₃, CaCO₃, Ca₃(PO₄)₂, CH₃COONa (সোডিয়াম অ্যাসিটেট), CH₃COOK প্রভৃতি।
দুর্বল এসিড ও দুর্বল ক্ষারের লবণের মধ্যে Al3+, Fe2+, Fe3+, Zn2+ এর কার্বনেট, ফসফেট, অ্যাসিটেট প্রভৃতি লবণগুলো সামান্য অম্লীয় প্রকৃতির। অর্থাৎ Al₂(CO₃)₃, FeCO₃, Fe₂(CO₃)₃, ZnCO₃, AlPO₄, Fe₃(PO₄)₂, FePO₄, Zn₃(PO₄)₂ এগুলো অম্লীয় প্রকৃতির।
অন্যদিকে NH4+ এর কার্বনেট, ফসফেট, অ্যাসিটেট প্রভৃতি লবণগুলো সামান্য ক্ষারীয় প্রকৃতির।
আমাদের লবণের প্রকৃতির আলোচনা থেকে সব উদাহরণ মনে রাখার দরকার নেই। Na⁺, K⁺, Ca2+ এর ক্লোরাইড, সালফেট ও নাইট্রেট নিরপেক্ষ প্রকৃতির; Na⁺, K⁺, Ca2+ এর কার্বনেট, বাইকার্বনেট ও ফসফেট ক্ষারীয় প্রকৃতির এবং Al3+, Fe2+, Fe3+ ও Zn2+ এর লবণগুলো অম্লীয় প্রকৃতির এটুকু শুধু খেয়াল রাখতে হবে।
দৈনন্দিন জীবনে প্রশমন বিক্রিয়ার গুরুত্ব
পরিপাক: খাদ্য হজম করতে পাকস্থলি HCl নিঃসরণ করে। পাকস্থলির আবরণীসহ প্রতিরক্ষা ব্যবস্থার কারণে সাধারণত এতে কোন সমস্যা হয় না। তবে কোন কারণে অতিরিক্ত HCl নিঃসরণ হলে তা প্রতিরক্ষা ব্যবস্থার ক্ষতি করে অথবা খাদ্যনালিতে পৌঁছে প্রদাহ সৃষ্টি করতে পারে। একে এসিডিটি বলে। বেশিদিন এসিডিটি হলে পাকস্থলিতে ঘা হয়ে যেতে পারে। এজন্য এসিডিটি হলে এন্টাসিড খেতে হয়।
পাঠ্যবইয়ের 9.5.1 (পৃষ্ঠা ২২৩ ও ২২৪ দ্রষ্টব্য)



